수경법을 익히려면 영양분을 남기고 혼합하는 능력이 중요합니다. 그러나 이것은 매우 힘들고 시간이 많이 걸리는 과정이라는 것을 이해해야합니다. 노련한 수경 재배자조차도 수경 재배 키트와 같은 기성품 공급 시스템을 선호합니다. 이것은 초보자에게 더 적합한 옵션이며 풍부한 원료 및 실험실 장비를 저장하지 않아도됩니다.
다음으로 주어진 영양소 농도의 용액 준비 및 준비의 예를 고려합니다.
양분 혼합물의 공식화를 시작하기 전에 주어진 문화, 기후 및 재배 방법에 가장 적합한 용액을 선택해야합니다. 영양소 혼합물 공급에 대한 권장 사항은 “영양 용액 선택”기사에 설명되어 있으며 선택을위한 용액의 기본은 “수경 재배를위한 영양소 혼합 레시피”사이트 섹션에 설명되어 있습니다.
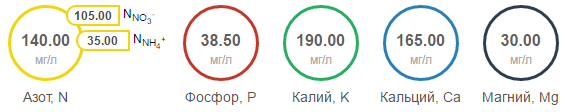
계산의 예를 들어, 매우 인기있는 “Chesnokov와 Bazyrina의 영양 솔루션”을 살펴 보겠습니다. 영양소의 농도는 1 리터 용액 [mg / l]의 원소 XNUMX 밀리그램으로 표시됩니다. 웹 사이트에서는 다음과 같이 보입니다.
편의상 표를 작성하는 것이 좋으며, Microsoft Excel이나 특수한 영양소 혼합 계산 프로그램을 사용하는 것이 편리합니다. 테이블은 다음과 같습니다.
블렌드 컴포넌트
우리는 g / l을 만듭니다.
N
P
K
Ca
Mg
…
완성 된 용액에서 mg / l
지정된 용액, mg / l
염기에서 표로 원소의 농도를 옮깁니다 (이 예에서는 암모늄과 질산 질소의 함량을 고려하지 않음).
블렌드 컴포넌트
우리는 g / l을 만듭니다.
N
P
K
Ca
Mg
…
완성 된 용액에서 mg / l
지정된 용액, mg / l
140
38.5
190
165
30
다음으로, 미래의 혼합물이 준비 될 물질을 선택해야합니다. 일반적으로 이들은 광물질 비료입니다.
하나의 물질로만 추가하려는 구성 요소에서 시작하는 것이 좋습니다. 나는 칼슘이나 마그네슘으로 시작하는 것을 선호합니다. 마그네슘부터 시작하겠습니다.
마그네슘

1 질량 단위의 MgO에 대해 0,603 질량 단위의 Mg가있는 것으로 알려져있다. 이 수치는 화합물 및 단순 물질의 몰 질량을 기준으로 계산되며 “산화 계수”라는 용어로 찾을 수 있습니다. 다른 물질에 대한 이러한 수치는 “산화 계수”기사에 나와 있거나 “화학 화합물의 몰 질량”기사 페이지의 온라인 몰 질량 계산기로 계산할 수 있습니다.
간단한 비율을 만들어 보겠습니다.
- 16,2g의 MgO를 1 질량 단위로하겠습니다.
- x g Mg는 0,603 질량 단위입니다.
x = 16.2 · 0.603 = 9.77g
우리는 다음과 같은 결과를 얻습니다 : 100g의 비료에는 9,77g의 순수한 마그네슘이 포함되어 있습니다. 테이블에 데이터를 입력 해 보겠습니다.
블렌드 컴포넌트
우리는 g / l을 만듭니다.
N
P
K
Ca
Mg
산화 마그네슘
황산 마그네슘, 중량 %
9.77
16.2
…
완성 된 용액에서 mg / l
지정된 용액, mg / l
140
38.5
190
165
30
이제 마그네슘 농도가 30mg / l 인 용액을 얻기 위해 적용해야 할 비료의 양을 계산해야합니다. 30mg / L의 농도는 1 리터의 용액에 30 밀리그램의 마그네슘이 포함되어 있거나 0,03 그램의 마그네슘이 포함되어 있음을 나타냅니다. 계산을 위해 다시 간단한 비율을 구성합니다.
- 100g의 비료는 9,77g의 Mg를 적용하고,
- 비료 xg은 Mg 0,03g을 추가합니다.
x = 100 · 0.03 / 9.77 = 0.31
결론 : 용액 0,31 리터당 1 그램의 황산 마그네슘 비료를 적용해야합니다. 표를 채워 봅시다 :
블렌드 컴포넌트
우리는 g / l을 만듭니다.
N
P
K
Ca
Mg
산화 마그네슘
황산 마그네슘, 중량 %
0,31
9.77
16.2
…
완성 된 용액에서 mg / l
30
지정된 용액, mg / l
140
38.5
190
165
30
칼슘

CaO의 산화물 계수는 0,715입니다. 비료 순수 칼슘 함량 :
Ca = 27 · 0.715 = 19.3 %
용액에 165 리터당 1mg의 칼슘을 첨가해야합니다.
- 100g의 비료는 19,3g의 Ca를 도입하고
- x 그램의 비료는 0,165 그램의 Ca를 추가합니다.
x = 100 · 0.165 / 19.3 = 0.855
결론 : 용액 0,855 리터당 1 그램의 질산 칼슘 비료를 적용해야합니다.
중요! 칼슘 외에 질산 칼슘은 용액에 질소를 추가한다는 것을 명심해야합니다. 비료의 질소 함량은 14,9 %입니다. 칼슘 외에 0,855g의 비료는 0,127mg에 해당하는 0,855g의 질소 (14,9 100 / 127)를 추가 할 것입니다. 표를 채워 봅시다 :
블렌드 컴포넌트
우리는 g / l을 만듭니다.
N
P
K
Ca
CaO를
Mg
산화 마그네슘
황산 마그네슘, 중량 %
0,31
9.77
16.2
질산 칼슘, 중량 %
0,855
14,9
19,3
27
…
완성 된 용액에서 mg / l
127
165
30
지정된 용액, mg / l
140
38.5
190
165
30
인
인은 과인산 염 또는 일 인산 칼륨의 형태로 영양 용액에 가장 자주 첨가됩니다. 이 예에서는 일 인산 칼륨을 사용합니다. 비료 구성은 다음과 같습니다 .P2O5 = 50 %, K2O = 33 %. 비료는 칼륨과 인을 모두 적용하므로 계산할 항목을 선택할 가치가 있습니다. 예를 들어, 처음에 옳은 추측을하지 못하는 최악의 시나리오를 생각해보십시오. 또한 이것이 무엇에 관한 것인지 더 명확해질 것입니다.
칼륨 계산을 시작합시다. 이전 계산과 유사 :
K에 대한 산화물 계수2O는 0.83입니다. 비료 순수 칼륨 함량 :
- K = 33 · 0.83 = 27.39 %
용액에 190 리터당 1mg의 칼륨을 첨가해야합니다.
- 100g의 비료는 27,39g의 K를 적용하고,
- x 그램의 비료는 0,190 그램 K를 추가합니다.
x = 100 · 0.190 / 27.39 = 0.69
결론 : 용액 0,69 리터당 1 그램의 “일 인산 칼륨”비료를 만들어야합니다.
중요! 칼륨과 함께 인도 도입됩니다.
P에 대한 산화물 계수2O5 0.436입니다. 비료 순수 인 함량 :
P = 50 · 0.436 = 21.8 %
0,69g의 “일 인산 칼륨”비료를 용액에 첨가하여 0,15g의 인 (0,69 · 21,8 / 100)을 추가합니다. 0,15g = 150mg으로, 우리가 필요로하는 것보다 훨씬 더 많습니다. 결론 : 우리는 인에서 시작하여 계산하고 있습니다.
인에 대한 계산. 이전 계산과 유사 :
P에 대한 산화물 계수2O5 0.436입니다. 비료 순수 인 함량 :
P = 50 · 0.436 = 21.8 %
용액에 38,5 리터당 1mg의 인을 첨가해야합니다.
- 100g의 비료는 21,8g의 P를 적용하고
- x 그램의 비료는 0,0385 그램 P를 추가합니다.
x = 100 · 0.0385 / 21.8 = 0.177
결론 : 용액 0.177 리터당 1 그램의 “일 인산 칼륨”비료를 만들어야합니다.
중요! 인과 함께 칼륨도 추가됩니다.
K에 대한 산화물 계수2O는 0.83입니다. 비료 순수 칼륨 함량 :
K = 33 · 0.83 = 27.39 %
0.177g의 “일 인산 칼륨”비료를 용액에 추가하여 0,048g의 칼륨 (0.177 · 27.39 / 100)을 추가합니다. 표를 채워 봅시다 :
블렌드 컴포넌트
우리는 g / l을 만듭니다.
N
P
P2O5
K
K2O
Ca
CaO를
Mg
산화 마그네슘
황산 마그네슘, 중량 %
0,31
9.77
16.2
질산 칼슘, 중량 %
0,855
14,9
19,3
27
일 인산 칼륨, 중량 %
0.177
21.8
50
27.39
33
…
완성 된 용액에서 mg / l
127
38.5
48
165
30
지정된 용액, mg / l
140
38.5
190
165
30
질소
용액에 약간의 질소와 칼륨을 첨가하는 것이 남아 있습니다. 질소부터 시작하겠습니다. 질소는 다양한 형태로 영양 용액에 첨가됩니다. 칼륨이 부족할 때 가장 적절하기 때문에 질산 칼륨을 사용할 것입니다. 질산 칼륨 (질산 칼륨)의 조성이 다음과 같다고 가정 해 보겠습니다. N = 13.6 %, K2O = 46 %.
비료의 질소 함량은 13.6 %입니다. 13mg의 질소 (140-127mg)를 추가해야합니다. 비율을 만들어 보겠습니다.
- 100g의 비료는 13,6g의 N을 적용하고,
- 잎 x 그램의 비료 0,013 그램의 N이 적용됩니다.
x = 100 · 0.013 / 13.6 = 0.096
결론 : 용액 0.096 리터당 1 그램의 질산 칼륨 비료를 적용해야합니다.
중요! 칼륨은 질소와 함께 첨가됩니다.
K에 대한 산화물 계수2O는 0.83입니다. 비료 순수 칼륨 함량 :
K = 46 · 0.83 = 38,18 %
0.096 그램의 질산 칼륨 비료를 용액에 추가하므로 0,037 그램의 칼륨 (0.096 · 38,18 / 100)이 추가됩니다. 총 85mg의 칼륨 (37 + 48g). 표를 채워 봅시다 :
블렌드 컴포넌트
우리는 g / l을 만듭니다.
N
P
P2O5
K
K2O
Ca
CaO를
Mg
산화 마그네슘
황산 마그네슘, 중량 %
0,31
9.77
16.2
질산 칼슘, 중량 %
0,855
14,9
19,3
27
일 인산 칼륨, 중량 %
0.177
21.8
50
27.39
33
질산 칼륨, 중량 %
0,096
13,6
38,18
46
…
완성 된 용액에서 mg / l
140
38.5
85
165
30
지정된 용액, mg / l
140
38.5
190
165
30
칼륨
누락 된 양의 칼륨을 도입하여 용액 준비를 완료합니다. 칼륨의 도입과 다른 원소의 비 도입을 위해 비료 “황산 칼륨”을 적용합니다. 황산 칼륨이 다음을 포함한다고 가정 해 봅시다 : K2O = 50 %.
K에 대한 산화물 계수2O는 0.83입니다. 비료 순수 칼륨 함량 :
K = 50 · 0.83 = 41.5 %
용액에 105 리터 (1-190g) 당 85mg의 칼륨을 첨가 할 필요가 있습니다.
- 100g의 비료는 41,5g의 K를 적용하고,
- x 그램의 비료는 0,105 그램 K를 추가합니다.
x = 100 · 0.105 / 41,5 = 0.253
결론 : 용액 0,253 리터당 1 그램의 황산 칼륨 비료를 적용해야합니다. 표를 채워 봅시다 :
블렌드 컴포넌트
우리는 g / l을 만듭니다.
N
P
P2O5
K
K2O
Ca
CaO를
Mg
산화 마그네슘
황산 마그네슘, 중량 %
0,31
9.77
16.2
질산 칼슘, 중량 %
0,855
14,9
19,3
27
일 인산 칼륨, 중량 %
0.177
21.8
50
27.39
33
질산 칼륨, 중량 %
0,096
13,6
38,18
46
황산 칼륨, 중량 %
0,253
41,5
50
완성 된 용액에서 mg / l
140
38.5
190
165
30
지정된 용액, mg / l
140
38.5
190
165
30
기성품 솔루션은 기성품에 해당합니다-솔루션은 올바르게 구성됩니다 더 많은 양의 솔루션을 준비하기 위해 적용된 양에 필요한 양 (리터)을 곱하여 간단한 재 계산을합니다. 5 리터 계산 예 :
블렌드 컴포넌트
우리는 g / l을 만듭니다.
우리는 g / 5l를 만듭니다.
마그네슘 설페이트
0,31
1,55
질산 칼슘
0,855
4,275
일 인산 칼륨
0.177
0,885
질산 칼륨
0,096
0,48
칼륨 황산염
0,253
1,265
아시다시피, 영양 용액 제조용 물에는 일정량의 용해 된 염이 포함될 수 있으며, 이는 영양 용액을 컴파일 할 때 고려해야합니다. 물의 구성이 다음과 같다고 가정 해 보겠습니다.
이름 Ca Mg K 함량, mg / l 50 25 30
해야 할 일은 계산을 시작하기 전에 솔루션의 구성을 수정하는 것입니다. 다음과 같이 보입니다.
블렌드 컴포넌트
우리는 g / l을 만듭니다.
N
P
K
Ca
Mg
…
완성 된 용액에서 mg / l
물의 조성, mg / l을 고려한 특정 용액
140
38,5
160
115
5
지정된 용액, mg / l
140
38.5
190
165
30
물, mg / l
30
50
25
다음으로 위에 게시 된 지침과 유사한 계산을 수행합니다.
분석 저울을 사용할 수없는 경우 소량 및 최소량의 물질을 계량하는 것이 어려울 수 있습니다. 이러한 목적으로 가정용 저울을 사용하면 최소 0,5g의 계량 정확도를 확신 할 수 없습니다. 정확한 저울없이 솔루션을 준비하는 간단한 방법이 있습니다. Hoagland에 따른 미량 원소 솔루션의 예를 고려해 봅시다.
소량으로 만 필요한 모든 미량 원소 화합물 (예 : 염화 주석, 요오드화 칼륨, 질산 코발트 등)의 0,5 % 용액을 증류수에 준비합시다. 따라서 예를 들어 5 리터의 증류수에 1g의 요오드화 칼륨을 녹일 것입니다. 0,5g 만 필요하면이 솔루션에서 100m0,5를 취합니다. cm, 정확히 18g을 포함합니다. 필요한 입방 센티미터의 양은 정확하고 저렴하지만 피펫, 주사기 또는 비커로 측정됩니다. 이 방법을 사용하면 Hoagland 용액 준비법에 따라 모든 양이 물 10 리터당 표시된다는 것을 잊지 마십시오. 따라서 우리가 준비한 모든 농축 물을 약 18 리터의 물에 별도로 녹인 후 물로 총 액체 량을 XNUMX 리터로 가져옵니다.
양액의 산성화
일반적으로 영양 용액은 산성화되어야합니다. 식물에 의한 이온 흡수는 용액의 점진적인 알칼리화를 일으 킵니다. pH가 7 이상인 용액은 대부분 최적의 pH로 조정해야합니다. 다양한 산을 사용하여 양액을 산성화 할 수 있지만 황산은 항상 구할 수 있고 저렴하기 때문에 일반적으로 사용됩니다.
산과 알칼리로 pH를 조절할 때 피부 화상을 방지하기 위해 고무 장갑을 착용해야합니다. 숙련 된 화학자는 진한 황산을 다루는 데 능숙하여 산을 한 방울 씩 물에 추가합니다. 그러나 초보 수경 재배자에게는 숙련 된 화학자에게 문의하여 25 % 황산 용액을 준비하도록 요청하는 것이 좋습니다. 산을 첨가하는 동안 용액을 교반하고 pH를 결정합니다. 대략적인 양의 황산을 배웠으므로 앞으로 눈금이 매겨진 실린더에서 추가 할 수 있습니다.
황산은 용액을 너무 많이 산성화하지 않도록 소량으로 첨가해야하며, 그런 다음 다시 알칼리화해야합니다. 경험이없는 작업자에게는 산성화와 알칼리화가 무기한으로 진행될 수 있습니다. 시간과 시약을 낭비하는 것 외에도 이러한 조절은 식물에 불필요한 이온 축적으로 인해 양액의 균형을 맞지 않습니다.
양액의 알칼리화
너무 산성 인 용액은 가성 나트륨 (수산화 나트륨)으로 알칼리성으로 만들어집니다. 이름에서 알 수 있듯이 부식성이 있으므로 고무 장갑을 착용해야합니다. 알약 형태로 수산화 나트륨을 구입하는 것이 좋습니다. 가정용 화학 제품 상점에서 수산화 나트륨은 두더지와 같은 파이프 클리너로 구입할 수 있습니다. 펠릿 하나를 물 0,5L에 녹이고 알칼리성 용액을 지속적으로 저으면서 영양 용액에 서서히 첨가하여 pH를 자주 확인합니다. 수학적 계산으로는 주어진 경우에 얼마나 많은 산이나 알칼리를 추가해야하는지 계산할 수 없습니다.
동일한 팔레트에서 여러 작물을 재배하려면 최적의 pH뿐만 아니라 다른 성장 인자에 대한 요구도 일치하도록 작물을 선택해야합니다. 예를 들어 노란 수선화와 국화는 pH 6,8이 필요하지만 수분 조건이 다르기 때문에 동일한 팔레트에서 재배 할 수 없습니다. 수선화에 국화만큼 수분을 주면 수선화 구근이 썩습니다. 실험에서 대황은 pH 6,5에서 최대 발달에 도달했지만 pH 3,5에서도 자랄 수 있습니다. 약 6의 pH를 선호하는 귀리는 영양 용액의 질소 용량이 크게 증가하면 pH 4에서 좋은 수확량을 제공합니다. 감자는 상당히 넓은 pH 범위에서 자라지 만 pH 5,5에서 가장 잘 자랍니다. 이 pH 이하에서는 고 수율의 괴경도 얻어 지지만 신맛이납니다. 최대 고품질 수율을 얻으려면 영양 용액의 pH를 정확하게 조정해야합니다.