Vedyn eksponentti (pH-tekijä) Se on liuoksessa olevien vetyionien aktiivisuuden mitta, joka ilmaisee kvantitatiivisesti niiden happamuuden. Kun pH ei ole optimaalisella tasolla, kasvit alkavat menettää kykyään imeä joitain terveelle kasvulle välttämättömiä alkuaineita. Kaikilla kasveilla on tietty pH-taso, joka mahdollistaa maksimaalisen kasvutuloksen. Useimmat kasvit pitävät hieman happamasta kasvuympäristöstä (5.5-6.5).
Vetyeksponentti kaavoissa
Hyvin laimeissa liuoksissa pH on yhtä suuri kuin vetyionien pitoisuus. Moduuliltaan yhtä suuri ja vastamerkki vetyionien aktiivisuuden desimaalilogaritmille, ilmaistuna mooleina litrassa:
pH = -lg [H+]
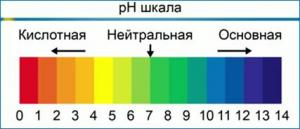
Normaaliolosuhteissa pH-arvo on välillä 0-14. Puhtaassa vedessä, neutraalissa pH:ssa, H-pitoisuus+ vastaa OH-pitoisuutta, ja se on 1-7 mooli litrassa. Suurin mahdollinen pH-arvo määritellään pH:n ja pOH:n summana ja se on 14.
Vastoin yleistä uskomusta, pH voi vaihdella paitsi välillä 0 – 14, mutta se voi myös ylittää nämä rajat. Esimerkiksi vetyionipitoisuudella [H+] = 10-15 mol / l, pH = 15, hydroksidi-ionien pitoisuudessa [OH,] 10 mol/L pOH = -1.
On tärkeää ymmärtää! pH-asteikko on logaritminen, mikä tarkoittaa, että jokainen muutosyksikkö vastaa kymmenkertaista muutosta vetyionien pitoisuudessa. Toisin sanoen pH 6 -liuos on kymmenen kertaa happamampi kuin pH 7 -liuos ja pH 5 -liuos on kymmenen kertaa happamampi kuin pH 6 -liuos ja sata kertaa happamampi kuin liuos pH 7. Se tarkoittaa, että kun säädät ravintoliuoksesi pH:ta ja sinun täytyy muuttaa pH:ta kahdessa pisteessä (esimerkiksi 7.5:stä 5.5:een), sinun tulee käyttää kymmenen kertaa enemmän pH-korjausainetta kuin jos muuttaisit pH:ta vain yhdessä pisteessä (alkaen 7.5 – 6.5).
Menetelmät pH-arvon määrittämiseksi.
Liuosten pH-arvon määrittämiseen käytetään laajasti erilaisia menetelmiä. PH voidaan arvioida karkeasti indikaattoreilla, mitata tarkasti pH-mittarilla tai määrittää analyyttisesti happo-emästitrauksella.
Happo-emäs-indikaattorit
Vetyionien pitoisuuden karkeaksi arvioimiseksi käytetään laajalti happo-emäs-indikaattoreita – orgaanisia väriaineita, joiden väri riippuu väliaineen pH:sta. Tunnetuimpia indikaattoreita ovat lakmus, fenolftaleiini, metyylioranssi (metyylioranssi) ja muut. Indikaattorit voivat esiintyä kahdessa eri värimuodossa: hapan tai emäksinen. Kunkin indikaattorin värinmuutos tapahtuu sen happamuusalueella, yleensä 1-2 yksikköä.
yleinen indikaattori

Tällaisten seosten liuokset: ”yleisindikaattorit” on yleensä kyllästetty ”indikaattoripaperin” kaistaleilla, joiden avulla voidaan nopeasti määrittää (pH-yksiköiden tai jopa pH:n kymmenysten tarkkuudella) happamuus. tutkittu vesiliuoksia. Tarkempaa määritystä varten pisaralla liuosta saadun indikaattoripaperin väriä verrataan välittömästi vertailuväriasteikkoon, jonka muoto näkyy kuvissa.
pH:n määrittäminen indikaattorimenetelmällä on vaikeaa sameille tai värillisille liuoksille.
Ottaen huomioon, että optimaaliset pH-arvot ravinneliuoksille hydroponiikassa ovat hyvin kapeat (yleensä 5.5-6.5), käytän myös muita indikaattoreiden yhdistelmiä. Esimerkiksi nestemäisen pH-testin toiminta-alue ja asteikko on 4.0-8.0, mikä tekee siitä tarkemman kuin yleisindikaattoripaperi.
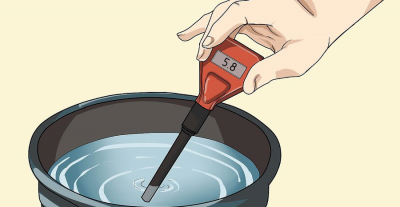
pH-mittari

Aiheen yksityiskohtaisempaa tutkimista varten suosittelemme vierailemaan foorumin vastaavassa osiossa: ”pHmeters”.
Volumetrinen analyysimenetelmä
Analyyttinen tilavuusmenetelmä, happo-emästitraus, antaa myös tarkat tulokset liuosten happamuuden määrittämiseen. Liuos, jonka pitoisuus tunnetaan (titraus), lisätään tipoittain testiliuokseen. Kun ne sekoitetaan keskenään, tapahtuu kemiallinen reaktio. Ekvivalenssipiste, aika, jolloin titrausaine on täsmälleen riittävä saattamaan reaktion täydellisesti loppuun, asetetaan indikaattorilla. Lisäksi, kun tiedetään lisätyn titrausliuoksen pitoisuus ja tilavuus, liuoksen happamuus lasketaan.
Lämpötilan vaikutus pH-arvoihin

Säädä ravintoliuoksen pH
Ravintoliuoksen happamoittaminen.
Yleensä ravinneliuosta on happamoitettava. Ionien imeytyminen kasveihin aiheuttaa liuoksen asteittaisen alkalistumisen. Mikä tahansa liuos, jonka pH on 7 tai enemmän, on usein säädettävä optimaaliseen pH-arvoon. Ravinneliuoksen happamoittamiseksi voidaan käyttää erilaisia happoja. Eniten käytetään rikki- tai fosforihappoja. Parempi ratkaisu hydroponisiin ratkaisuihin ovat puskurit, kuten pH miinus Bloom ja pH miinus Grow. Nämä rahastot eivät vain tuo pH-arvoja optimaalisiksi, vaan myös stabiloivat arvot pitkäksi aikaa.
Kun pH säädetään hapoilla ja emäksillä, on käytettävä kumikäsineitä ihon palovammojen välttämiseksi. Kokenut kemisti on taitava käsittelemään väkevää rikkihappoa lisäämällä happoa tipoittain veteen. Mutta vesiviljelyn aloittelijoille voi olla parasta kääntyä kokeneen kemistin puoleen ja pyytää häntä valmistamaan 25-prosenttinen rikkihappoliuos. Kun happoa lisätään, liuosta sekoitetaan ja sen pH määritetään. Kun olet oppinut likimääräisen rikkihapon määrän, sitä voidaan tulevaisuudessa lisätä asteikolla varustetusta sylinteristä.
Rikkihappoa tulee lisätä pieninä annoksina, jotta liuos ei happamoi liikaa, vaan se on sitten tehtävä uudelleen emäksiseksi. Kokemattomalla työntekijällä happamoitumista ja alkalointia voi jatkua loputtomiin. Ajan ja reagenssien tuhlaamisen lisäksi tällainen säätely epätasapainottaa ravinneliuosta, koska kasveille kertyy tarpeettomia ioneja.
Ravintoliuoksen alkalointi.
Liian happamat liuokset tehdään emäksiseksi emäksisellä natriumilla (natriumhydroksidi). Kuten nimestä voi päätellä, se on syövyttävää, joten kumihanskoja kannattaa käyttää. On suositeltavaa ostaa natriumhydroksidia pillerimuodossa. Natriumhydroksidia voi ostaa putkenpuhdistusaineina kotitalouskemikaaliliikkeistä, kuten Molesta. Liuota yksi rake 0,5 litraan vettä ja lisää emäksinen liuos vähitellen ravintoliuokseen jatkuvasti sekoittaen ja tarkista sen pH usein. Mikään matemaattinen laskelma ei voi laskea lisättävän hapon tai alkalin määrää tietyssä tapauksessa.
Jos haluat kasvattaa useita kasveja lastalla, sinun on valittava ne vastaamaan optimaalisen pH:n lisäksi myös muiden kasvutekijöiden tarpeita. Esimerkiksi narsissit ja keltaiset krysanteemit tarvitsevat pH-arvon 6,8, mutta erilaiset kosteusolosuhteet, joten niitä ei voida kasvattaa samalla lavalla. Jos annat narsissille yhtä paljon kosteutta kuin krysanteemille, narsissin sipulit mätänevät. Kokeissa raparperi saavutti maksimikehityksensä pH:ssa 6,5, mutta pystyi kasvamaan jopa pH:ssa 3,5. Kaura, joka suosii pH-arvoa noin 6, antaa hyvän sadon pH:ssa 4, jos ravinneliuoksen typen annos kasvaa huomattavasti. Perunat kasvavat melko laajalla pH-alueella, mutta ne viihtyvät parhaiten pH:ssa 5,5. Tämän pH:n alapuolella saadaan myös suuria saantoja mukuloita, mutta ne saavat kitkerän maun. Maksimaalisen korkealaatuisen tuoton saamiseksi ravinneliuosten pH on säädettävä tarkasti.