Die Wasserhärte ist eine Kombination chemischer und physikalischer Eigenschaften, die mit dem Gehalt an gelösten Salzen von Erdalkalimetallen, hauptsächlich Calcium und Magnesium, verbunden sind – den sogenannten „Härtesalzen“.
Wasser mit 100-150 mg Calcium pro Liter ist für die Hydrokultur akzeptabel und im Prinzip ist für die meisten Pflanzen keine zusätzliche Zugabe von Calcium erforderlich.
Weiches Wasser enthält weniger als 50 mg Calcium pro Liter. Für ein erfolgreiches Pflanzenwachstum ist es notwendig, zusätzlich Calcium- und Magnesiumsalze zuzusetzen.
Hydroponische Düngemittelhersteller berücksichtigen das Vorhandensein von Kalzium und Magnesium in ihren Formulierungen und produzieren Düngervariationen für hartes und weiches Wasser.
Die Wasserhärte wird zwischen temporär (Karbonat) und permanent unterschieden.
Temporäre Wasserhärte
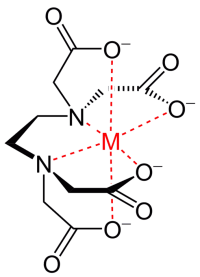
Temporäre Härte ist eine Art von Wasserhärte, die durch das Vorhandensein von gelöstem Calciumcarbonat und Magnesiumcarbonat verursacht wird. Wenn sich diese Mineralien in Lösung auflösen, werden Calcium- und Magnesiumkationen (Ca2+, Mg2+) und Carbonat- und Bicarbonat-Anionen32-, HCO3–). Der optimale pH-Wert für Hydroponik liegt bei 5,5. Der pH-Wert des Wassers ist zu hoch, wenn das Gießwasser erhebliche Mengen an Karbonat und Bikarbonat (CO .) enthält32-, HCO3–). Dies ist häufig bei der Verwendung von Brunnenwasser der Fall. Daher muss dieses Wasser mit Säure behandelt werden, um das HCO . zu neutralisieren3– und den pH-Wert der Nährlösung zu senken. Die zuzugebende Säuremenge wird durch den HCO-Gehalt bestimmt3–… Wenn dem Wasser Säure zugesetzt wird, wird das Bicarbonat durch das Proton der Säure neutralisiert und der pH-Wert der Lösung sinkt. Calcium (oder Magnesium) bleibt für die Aufnahme durch Pflanzen verfügbar und das Säureanion bleibt im Wasser gelöst. Bei der Zugabe von Salpetersäure findet beispielsweise folgende Reaktion statt:
Ca2+ + 2HCO3– + 2HNO3 Ca2+ + 2CO2 + 2H2O + 2NO3–
Zu diesem Zweck wird häufig Salpetersäure verwendet, aber auch Phosphorsäure und ihre Derivate wie Harnstoffphosphat können verwendet werden. Durch Zugabe von mehr Säure wird die Konzentration assoziierter Anionen in der Lösung, wie Nitrat und Phosphat, erhöht. Diese Werte sollten die erforderliche Konzentration für die Nährlösung nicht überschreiten. Dies begrenzt die Menge an Säure, die hinzugefügt werden kann, um HCO added zu neutralisieren3… Daher ist die Anfangskonzentration von HCO3– im Wasser ist ein großes Qualitätsproblem.
Durch die Neutralisation von Bicarbonat mit einer Säure wird Kohlendioxid (CO .) freigesetzt2) und Wasser. CO2 muss die Nährlösung frei verlassen; andernfalls wird der pH-Wert der Lösung nicht erniedrigt und schwankt. Dies bedeutet, dass die Reaktion von Säure und Bicarbonat in offenen Systemen wie einem offenen Mischbehälter erfolgen muss.