waterstof exponent (pH-factor) Het is een maat voor de activiteit van waterstofionen in een oplossing, waarbij hun zuurgraad kwantitatief wordt uitgedrukt. Wanneer de pH niet optimaal is, beginnen planten hun vermogen te verliezen om enkele van de elementen die nodig zijn voor een gezonde groei te absorberen. Alle planten hebben een specifieke pH-waarde die zorgt voor maximale groeiresultaten. De meeste planten geven de voorkeur aan een licht zure groeiomgeving (tussen 5.5 en 6.5).
Waterstofexponent in formules
In zeer verdunde oplossingen is de pH gelijk aan de concentratie waterstofionen. Gelijk in modulus en tegengesteld teken aan de decimale logaritme van de activiteit van waterstofionen, uitgedrukt in mol per liter:
pH = -lg [H+]
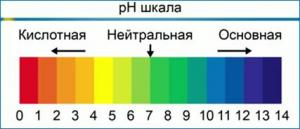
Onder standaardomstandigheden ligt de pH-waarde in het bereik van 0 tot 14. In zuiver water, bij neutrale pH, is de concentratie van H+ is gelijk aan de OH-concentratie, en het is 1 10-7 mol per liter. De maximaal mogelijke pH-waarde wordt gedefinieerd als de som van pH en pOH en is gelijk aan 14.
In tegenstelling tot wat vaak wordt gedacht, kan de pH niet alleen variëren van 0 tot 14, maar ook buiten deze limieten gaan. Bijvoorbeeld bij een waterstofionenconcentratie [H+] = 10-15 mol / l, pH = 15, bij een concentratie van hydroxide-ionen [OH,] 10 mol/L pOH = -1.
Het is belangrijk om te begrijpen! De pH-schaal is logaritmisch, wat betekent dat elke veranderingseenheid gelijk staat aan een tienvoudige verandering in de concentratie van waterstofionen. Met andere woorden, een oplossing met pH 6 is tien keer zuurder dan een oplossing met pH 7, en een oplossing met pH 5 zal tien keer zuurder zijn dan een oplossing met pH 6 en honderd keer zuurder dan een oplossing met pH 7. Dit betekent dat wanneer u de pH van uw voedingsoplossing aanpast en u de pH op twee punten moet veranderen (bijvoorbeeld van 7.5 naar 5.5), moet u tien keer meer pH-corrector gebruiken dan wanneer u de pH op slechts één punt zou veranderen (van 7.5 tot 6.5).
Methoden voor het bepalen van de pH-waarde.
Er worden veel methoden gebruikt om de pH-waarde van oplossingen te bepalen. PH kan ruwweg worden geschat door indicatoren, nauwkeurig gemeten met een pH-meter of analytisch bepaald door zuur-base titratie.
Indicatoren op zuurbasis
Voor een ruwe schatting van de concentratie van waterstofionen worden veel zuur-base-indicatoren gebruikt – organische kleurstoffen, waarvan de kleur afhangt van de pH van het medium. De meest bekende indicatoren zijn lakmoes, fenolftaleïne, methyloranje (methyloranje) en andere. Indicatoren kunnen in twee verschillende kleurvormen voorkomen: zuur of basisch. De kleurverandering van elke indicator vindt plaats in het zuurgraadbereik, meestal 1-2 eenheden.
universele indicator

Oplossingen van dergelijke mengsels: “universele indicatoren” zijn meestal geïmpregneerd met stroken “indicatorpapier”, waarmee het mogelijk is om snel (met een nauwkeurigheid van pH-eenheden of zelfs tienden van een pH) de zuurgraad van de waterige oplossingen onderzocht. Voor een nauwkeurigere bepaling wordt de kleur van het indicatorpapier, verkregen door het aanbrengen van een druppel oplossing, onmiddellijk vergeleken met een referentiekleurenschaal, waarvan de vorm in de afbeeldingen wordt weergegeven.
Bepaling van de pH door de indicatormethode is moeilijk voor troebele of gekleurde oplossingen.
Gezien het feit dat de optimale pH-waarden voor voedingsoplossingen in hydrocultuur een zeer smal bereik hebben (over het algemeen 5.5 tot 6.5), gebruik ik ook andere combinaties van indicatoren. Onze vloeibare pH-test heeft bijvoorbeeld een werkbereik en schaal van 4.0 tot 8.0, wat hem nauwkeuriger maakt dan een universeel indicatorpapier.
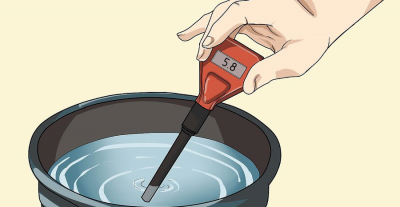
pH-meter

Voor een meer gedetailleerde studie van het onderwerp raden we aan om de overeenkomstige sectie van het forum te bezoeken: “pHmeters”.
Volumetrische analysemethode
De analytische volumetrische methode, zuur-base titratie, levert ook nauwkeurige resultaten op voor het bepalen van de zuurgraad van oplossingen. Een oplossing met bekende concentratie (titrant) wordt druppelsgewijs aan de testoplossing toegevoegd. Wanneer ze met elkaar worden gemengd, treedt er een chemische reactie op. Het equivalentiepunt, het tijdstip waarop de titrant precies genoeg is om de reactie volledig te voltooien, wordt bepaald door een indicator. Bovendien wordt de zuurgraad van de oplossing berekend als de concentratie en het volume van de toegevoegde titratieoplossing bekend zijn.
Effect van temperatuur op pH-waarden

Pas de pH van de voedingsoplossing aan
Verzuring van de voedingsoplossing.
Over het algemeen is het noodzakelijk om de voedingsoplossing aan te zuren. De opname van ionen door planten veroorzaakt een geleidelijke alkalisering van de oplossing. Elke oplossing met een pH van 7 of hoger moet vaak worden aangepast aan de optimale pH. Om de voedingsoplossing aan te zuren kunnen verschillende zuren worden gebruikt. Zwavel- of fosforzuren worden het meest gebruikt. Een betere oplossing voor hydrocultuuroplossingen zijn buffers zoals pH minus Bloom en pH minus Grow. Deze fondsen brengen niet alleen de pH-waarden naar het optimale, maar stabiliseren de waarden ook voor een langere periode.
Bij het aanpassen van de pH met zuren en logen moeten rubberen handschoenen worden gedragen om brandwonden op de huid te voorkomen. Een ervaren chemicus is bedreven in het omgaan met geconcentreerd zwavelzuur en voegt het zuur druppel voor druppel toe aan het water. Maar voor beginnende hydrocultuur is het misschien het beste om naar een ervaren chemicus te gaan en hem te vragen een 25% zwavelzuuroplossing te bereiden. Terwijl het zuur wordt toegevoegd, wordt de oplossing geroerd en wordt de pH bepaald. Na de geschatte hoeveelheid zwavelzuur te hebben geleerd, kan het in de toekomst worden toegevoegd vanuit een maatcilinder.
Zwavelzuur moet in kleine porties worden toegevoegd om de oplossing niet te zuur te maken, die dan weer alkalisch moet worden gemaakt. Bij een onervaren werknemer kan de verzuring en alkalisatie oneindig doorgaan. Naast het verspillen van tijd en reagentia, brengt een dergelijke regeling de voedingsoplossing uit balans vanwege de ophoping van onnodige ionen voor de planten.
Alkalisatie van de voedingsoplossing.
Te zure oplossingen worden alkalisch gemaakt met natriumhydroxide (natriumhydroxide). Zoals de naam al doet vermoeden, is het bijtend, daarom moeten rubberen handschoenen worden gedragen. Het wordt aanbevolen om natriumhydroxide in pilvorm te kopen. Natriumhydroxide kan worden gekocht als pijpreinigers bij huishoudelijke chemische winkels, zoals Mole. Los één korrel op in 0,5 L water en voeg geleidelijk de alkalische oplossing toe aan de voedingsoplossing onder constant roeren, waarbij regelmatig de pH wordt gecontroleerd. Geen enkele wiskundige berekening kan de hoeveelheid zuur of alkali berekenen die in een bepaald geval moet worden toegevoegd.
Als u meerdere gewassen op een troffel wilt laten groeien, moet u ze zodanig selecteren dat ze niet alleen overeenkomen met hun optimale pH, maar ook met de behoeften van andere groeifactoren. Narcissen en gele chrysanten hebben bijvoorbeeld een pH van 6,8 nodig, maar verschillende vochtigheidscondities, zodat ze niet op hetzelfde pallet kunnen worden gekweekt. Als je narcissen evenveel vocht geeft als chrysanten, gaan de narcisbollen rotten. In experimenten bereikte rabarber zijn maximale ontwikkeling bij pH 6,5, maar kon zelfs bij pH 3,5 groeien. Haver, die de voorkeur geeft aan een pH van ongeveer 6, geeft goede opbrengsten bij pH 4, als de dosis stikstof in de voedingsoplossing aanzienlijk toeneemt. Aardappelen groeien in een vrij breed pH-bereik, maar gedijen het beste bij een pH van 5,5. Beneden deze pH worden ook hoge opbrengsten aan knollen verkregen, maar deze krijgen een bittere smaak. Voor een maximale opbrengst van hoge kwaliteit moet de pH van voedingsoplossingen nauwkeurig worden aangepast.