Expoente de hidrogênio (fator de pH) É uma medida da atividade dos íons de hidrogênio em uma solução, expressando quantitativamente sua acidez. Quando o pH não está nos níveis ideais, as plantas começam a perder sua capacidade de absorver alguns dos elementos necessários para um crescimento saudável. Todas as plantas têm um nível de pH específico que permite resultados de crescimento máximos. A maioria das plantas prefere um meio de crescimento ligeiramente ácido (entre 5.5-6.5).
Expoente de hidrogênio em fórmulas
Em soluções muito diluídas, o pH é equivalente à concentração de íons de hidrogênio. Igual em módulo e oposto em sinal ao logaritmo decimal da atividade de íons de hidrogênio, expresso em moles por litro:
pH = -lg [H+]
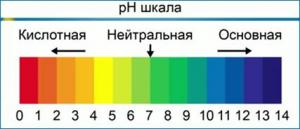
Em condições padrão, o valor de pH está na faixa de 0 a 14. Em água pura, em pH neutro, a concentração de H+ é igual à concentração de OH– e é 1 10-7 mole por litro. O valor máximo de pH possível é definido como a soma de pH e pOH e é igual a 14.
Ao contrário da crença popular, o pH pode variar não apenas na faixa de 0 a 14, mas também pode ir além desses limites. Por exemplo, a uma concentração de íons de hidrogênio [H+] = 10-15 mol / l, pH = 15, a uma concentração de íons hidróxido [OH–] 10 mol / L pOH = -1.
É importante entender! A escala de pH é logarítmica, o que significa que cada unidade de mudança é igual a uma variação de dez vezes na concentração de íons de hidrogênio. Em outras palavras, uma solução de pH 6 é dez vezes mais ácida do que uma solução de pH 7, e uma solução de pH 5 será dez vezes mais ácida do que uma solução de pH 6 e cem vezes mais ácida do que uma solução de pH 7. significa que quando você está ajustando o pH de sua solução nutritiva e precisa mudar o pH em dois pontos (por exemplo, de 7.5 para 5.5), você deve usar dez vezes mais corretor de pH do que se estivesse mudando o pH em apenas um ponto (de 7.5 a 6.5).
Métodos de determinação de pH
Vários métodos são amplamente usados para determinar o valor de pH das soluções. O pH pode ser estimado aproximadamente usando indicadores, medido com precisão com um medidor de pH ou determinado analiticamente por titulação ácido-base.
Indicadores de ácido-base
Para uma estimativa aproximada da concentração de íons de hidrogênio, indicadores de ácido-base são amplamente usados - substâncias corantes orgânicas, cuja cor depende do pH do meio. Os indicadores mais famosos incluem tornassol, fenolftaleína, laranja de metila (laranja de metila) e outros. Os indicadores podem existir em duas formas de cores diferentes – ácidas ou básicas. A mudança de cor de cada indicador ocorre em sua faixa de acidez, geralmente 1–2 unidades.
Indicador universal

Soluções dessas misturas – “indicadores universais” geralmente são impregnados com tiras de “papel indicador”, com o auxílio do qual é possível determinar rapidamente (com uma precisão de unidades de pH, ou mesmo décimos de pH) a acidez do investigado soluções aquosas. Para uma determinação mais precisa, a cor do papel indicador obtido na aplicação de uma gota da solução é imediatamente comparada com a escala de cores de referência, cuja forma é mostrada nas imagens.
A determinação do pH pelo método do indicador é difícil para soluções turvas ou coloridas.
Considerando o fato de que os valores ideais de pH para soluções nutritivas em hidroponia têm uma faixa muito estreita (geralmente de 5.5 a 6.5), também uso outras combinações de indicadores. Por exemplo, nosso teste de pH líquido tem uma faixa operacional e escala de 4.0 a 8.0, tornando-o mais preciso do que um papel indicador universal.
medidor de pH

Para um estudo mais detalhado do tema, recomendamos visitar a seção correspondente do fórum: “medidores de pH”.
Método volumétrico analítico
O método volumétrico analítico – titulação ácido-base – também fornece resultados precisos para a determinação da acidez das soluções. Uma solução de concentração conhecida (titulante) é adicionada gota a gota à solução de teste. Quando eles são misturados, ocorre uma reação química. O ponto de equivalência – o momento em que o titulante é exatamente o suficiente para completar completamente a reação – é fixado por meio de um indicador. Além disso, conhecendo a concentração e o volume da solução de titulante adicionada, a acidez da solução é calculada.
Efeito da temperatura nos valores de pH

Ajustando o pH da solução nutritiva
Acidificação da solução nutritiva
A solução nutritiva geralmente precisa ser acidificada. A absorção de íons pelas plantas causa uma alcalinização gradual da solução. Qualquer solução com um pH de 7 ou superior, na maioria das vezes, precisará ser ajustada para o pH ideal. Vários ácidos podem ser usados para acidificar a solução nutritiva. Os ácidos sulfúrico ou fosfórico são os mais comumente usados. Uma solução melhor para soluções hidropônicas são buffers como pH menos Bloom e pH menos Grow. Esses fundos não apenas trazem os valores de pH para o ótimo, mas também estabilizam os valores por um longo período.
Ao ajustar o pH com ácidos e álcalis, luvas de borracha devem ser usadas para evitar queimaduras na pele. Um químico experiente é adepto do tratamento de ácido sulfúrico concentrado, adicionando o ácido gota a gota à água. Mas para hidroponistas novatos, talvez seja melhor recorrer a um químico experiente e pedir-lhe que prepare uma solução de ácido sulfúrico a 25%. Enquanto o ácido é adicionado, a solução é agitada e seu pH é determinado. Tendo aprendido a quantidade aproximada de ácido sulfúrico, no futuro ele pode ser adicionado a partir de um cilindro graduado.
O ácido sulfúrico deve ser adicionado em pequenas porções para não acidificar muito a solução, que então deverá ser alcalinizada novamente. Em um trabalhador inexperiente, a acidificação e a alcalinização podem durar indefinidamente. Além de desperdiçar tempo e reagentes, tal regulação desequilibra a solução nutritiva devido ao acúmulo de íons desnecessários às plantas.
Alcalinização da solução nutritiva
Soluções muito ácidas são tornadas alcalinas com sódio cáustico (hidróxido de sódio). Como o nome sugere, é corrosivo, portanto, luvas de borracha devem ser usadas. Recomenda-se comprar hidróxido de sódio em forma de comprimido. Em lojas de produtos químicos domésticos, o hidróxido de sódio pode ser comprado como um limpador de cachimbo, como o Mole. Dissolva um pellet em 0,5 L de água e adicione gradualmente a solução alcalina à solução nutritiva com agitação constante, verificando frequentemente o seu pH. Nenhum cálculo matemático pode calcular quanto ácido ou álcali precisa ser adicionado em um determinado caso.
Se você deseja cultivar várias safras em um palete, é necessário selecioná-las de forma que não apenas o pH ideal corresponda, mas também as necessidades de outros fatores de crescimento. Por exemplo, narcisos amarelos e crisântemos precisam de um pH de 6,8, mas em diferentes condições de umidade, de modo que não podem ser cultivados no mesmo palete. Se você der aos narcisos tanta umidade quanto os crisântemos, os bulbos de narcisos apodrecerão. Em experimentos, o ruibarbo atingiu seu máximo desenvolvimento em pH 6,5, mas pode crescer mesmo em pH 3,5. Aveia, que prefere um pH de cerca de 6, dá bons rendimentos em pH 4, se a dose de nitrogênio na solução nutritiva for muito aumentada. As batatas crescem em uma faixa de pH bastante ampla, mas se desenvolvem melhor em um pH de 5,5. Abaixo desse pH, também são obtidos altos rendimentos de tubérculos, mas eles adquirem um sabor azedo. Para obter rendimentos máximos de alta qualidade, o pH das soluções nutritivas deve ser ajustado com precisão.