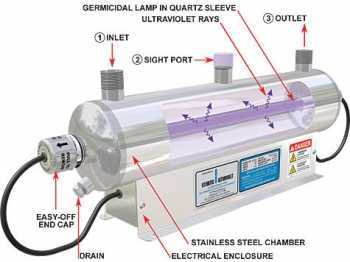
La dureté de l’eau est une combinaison de propriétés chimiques et physiques associées à la teneur en sels dissous de métaux alcalino-terreux, principalement de calcium et de magnésium – les « sels de dureté ».
Une eau contenant 100-150 mg de calcium par litre est acceptable pour une utilisation hydroponique et, en principe, pour la plupart des plantes, il n’est pas nécessaire d’ajouter du calcium supplémentaire.
L’eau douce contient moins de 50 mg de calcium par litre. Pour une croissance réussie des plantes, il est nécessaire d’ajouter en plus des sels de calcium et de magnésium.
Les fabricants d’engrais hydroponiques tiennent compte de la présence de calcium et de magnésium dans leurs formulations et produisent des variations d’engrais pour les eaux dures et douces.
La dureté de l’eau est distinguée entre temporaire (carbonate) et permanente.
Dureté de l’eau temporaire
La dureté temporaire est un type de dureté de l’eau causée par la présence de carbonate de calcium et de carbonate de magnésium dissous. Lorsque ces minéraux se dissolvent en solution, les cations calcium et magnésium (Ca2+, Mg2+) et les anions carbonate et bicarbonate32-, HCO3–). Le pH optimal pour la culture hydroponique est de 5,5. Le pH de l’eau sera trop élevé si l’eau d’irrigation contient des quantités importantes de carbonate et de bicarbonate (CO32-, HCO3–). C’est souvent le cas lorsqu’on utilise de l’eau de puits. Par conséquent, cette eau doit être traitée à l’acide pour neutraliser le HCO3– et pour abaisser le pH de la solution nutritive. La quantité d’acide à ajouter est déterminée par la teneur en HCO3–… Lorsque l’acide est ajouté à l’eau, le bicarbonate est neutralisé par le proton de l’acide et le pH de la solution diminue. Le calcium (ou magnésium) restera disponible pour l’absorption par les plantes et l’anion acide restera dissous dans l’eau. Par exemple, lors de l’ajout d’acide nitrique, la réaction suivante aura lieu :
Ca2+ + 2HCO3– + 2HNO3 Ca2+ + 2CO2 + 2H2O + 2NO3–
L’acide nitrique est largement utilisé à cette fin, mais l’acide phosphorique et ses dérivés tels que le phosphate d’urée peuvent également être utilisés. En ajoutant plus d’acide, la concentration des anions associés en solution, tels que le nitrate et le phosphate, augmentera. Ces valeurs ne doivent pas dépasser la concentration requise pour la solution nutritive. Cela limite la quantité d’acide qui peut être ajoutée pour neutraliser le HCO3… Par conséquent, la concentration initiale de HCO3– dans l’eau est un problème de qualité majeur.
La neutralisation du bicarbonate par un acide initie le dégagement de dioxyde de carbone (CO2) et de l’eau. CO2 doit quitter librement la solution nutritive; sinon, le pH de la solution ne sera pas abaissé et fluctuera. Cela signifie que la réaction de l’acide et du bicarbonate doit avoir lieu dans des systèmes ouverts tels qu’un réservoir de mélange ouvert.