Wykładnik wodoru (współczynnik pH) Jest miarą aktywności jonów wodorowych w roztworze, wyrażającą ilościowo jego kwasowość. Gdy pH nie jest na optymalnym poziomie, rośliny zaczynają tracić zdolność do wchłaniania niektórych pierwiastków potrzebnych do zdrowego wzrostu. Wszystkie rośliny mają określony poziom pH, który pozwala na maksymalne rezultaty wzrostu. Większość roślin preferuje lekko kwaśne środowisko wzrostu (między 5.5-6.5).
Wykładnik wodoru we wzorach
W bardzo rozcieńczonych roztworach pH odpowiada stężeniu jonów wodorowych. Równy moduł i przeciwny do logarytmu dziesiętnego aktywności jonów wodorowych, wyrażony w molach na litr:
pH = -lg[H+]
W normalnych warunkach wartość pH mieści się w zakresie od 0 do 14. W czystej wodzie, przy neutralnym pH, stężenie H+ jest równy stężeniu OH– i wynosi 1 10-7 mol na litr. Maksymalna możliwa wartość pH jest zdefiniowana jako suma pH i pOH i wynosi 14.
Wbrew powszechnemu przekonaniu pH może wahać się nie tylko w zakresie od 0 do 14, ale może również wykraczać poza te granice. Na przykład przy stężeniu jonów wodorowych [H+] = 10-15 mol/l, pH = 15, przy stężeniu jonów wodorotlenowych [OH–] 10 mol/L pOH = -1.
Ważne jest, aby zrozumieć! Skala pH jest logarytmiczna, co oznacza, że każda jednostka zmiany odpowiada dziesięciokrotnej zmianie stężenia jonów wodorowych. Innymi słowy, roztwór o pH 6 jest dziesięciokrotnie bardziej kwaśny niż roztwór o pH 7, a roztwór o pH 5 będzie dziesięciokrotnie bardziej kwaśny niż roztwór o pH 6 i sto razy bardziej kwaśny niż roztwór o pH 7. Oznacza to, że kiedy regulujesz pH odżywki i musisz zmienić pH o dwa punkty (np. z 7.5 na 5.5) powinieneś użyć dziesięciokrotnie więcej korektora pH niż gdybyś zmieniał pH tylko o jeden punkt (z 7.5 do 6.5).
Metody oznaczania pH
Do określania wartości pH roztworów powszechnie stosuje się kilka metod. Wartość pH można z grubsza oszacować za pomocą wskaźników, dokładnie zmierzyć pH-metrem lub określić analitycznie przez miareczkowanie kwasowo-zasadowe.
Wskaźniki kwasowo-zasadowe
Do zgrubnego oszacowania stężenia jonów wodorowych szeroko stosuje się wskaźniki kwasowo-zasadowe – organiczne substancje barwiące, których kolor zależy od pH podłoża. Najbardziej znane wskaźniki to lakmus, fenoloftaleina, oranż metylowy (pomarańcza metylowa) i inne. Wskaźniki mogą występować w dwóch różnokolorowych formach – kwasowej lub zasadowej. Zmiana koloru każdego wskaźnika następuje w jego zakresie kwasowości, zwykle 1-2 jednostki.
Uniwersalny wskaźnik

Roztwory takich mieszanin – „wskaźniki uniwersalne” są zwykle impregnowane paskami „papierka wskaźnikowego”, za pomocą którego można szybko (z dokładnością jednostek pH, a nawet dziesiątych części pH) określić kwasowość badanych roztwory wodne. W celu dokładniejszego określenia kolor papierka wskaźnikowego uzyskany po nałożeniu kropli roztworu jest natychmiast porównywany z referencyjną skalą kolorów, której postać pokazano na obrazach.
Oznaczanie pH metodą wskaźnikową jest trudne dla roztworów mętnych lub barwnych.
Biorąc pod uwagę fakt, że optymalne wartości pH dla pożywek w hydroponice mają bardzo wąski zakres (zazwyczaj od 5.5 do 6.5), stosuję również inne kombinacje wskaźników. Na przykład nasz płynny test pH ma zakres roboczy i skalę od 4.0 do 8.0, dzięki czemu jest dokładniejszy niż uniwersalny papierek wskaźnikowy.
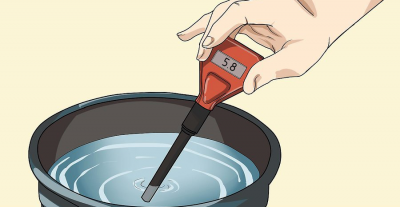
pH-metr

W celu bardziej szczegółowego przestudiowania tematu zalecamy odwiedzenie odpowiedniej sekcji forum: „mierniki pH”.
Analityczna metoda wolumetryczna
Analityczna metoda wolumetryczna – miareczkowanie kwasowo-zasadowe – daje również dokładne wyniki do oznaczania kwasowości roztworów. Do roztworu testowego dodaje się kroplami roztwór o znanym stężeniu (titrat). Po zmieszaniu zachodzi reakcja chemiczna. Punkt równoważnikowy – moment, w którym titrant wystarcza dokładnie do całkowitego zakończenia reakcji – ustala się za pomocą wskaźnika. Ponadto, znając stężenie i objętość dodawanego roztworu titranta, oblicza się kwasowość roztworu.
Wpływ temperatury na wartości pH

Regulacja pH pożywki
Zakwaszenie pożywki
Pożywka zwykle wymaga zakwaszenia. Absorpcja jonów przez rośliny powoduje stopniową alkalizację roztworu. Każdy roztwór o pH 7 lub wyższym będzie najczęściej wymagał dostosowania do optymalnego pH. Do zakwaszenia pożywki można użyć różnych kwasów. Najczęściej stosuje się kwas siarkowy lub fosforowy. Lepszym rozwiązaniem dla roztworów hydroponicznych są bufory takie jak pH minus Bloom i pH minus Grow. Środki te nie tylko doprowadzają wartości pH do optymalnych, ale także stabilizują wartości na długi okres.
Podczas dostosowywania pH zarówno za pomocą kwasów, jak i zasad, należy nosić gumowe rękawiczki, aby uniknąć oparzeń skóry. Doświadczony chemik jest biegły w obchodzeniu się ze stężonym kwasem siarkowym, dodając go kropla po kropli do wody. Ale dla początkujących hydroponistów może lepiej zwrócić się do doświadczonego chemika i poprosić go o przygotowanie 25% roztworu kwasu siarkowego. Podczas dodawania kwasu roztwór miesza się i określa jego pH. Po poznaniu przybliżonej ilości kwasu siarkowego, w przyszłości można go dodać z cylindra miarowego.
Kwas siarkowy należy dodawać małymi porcjami, aby zbytnio nie zakwasić roztworu, który następnie trzeba będzie ponownie zalkalizować. U niedoświadczonego pracownika zakwaszanie i alkalizacja mogą trwać w nieskończoność. Oprócz marnowania czasu i odczynników, taka regulacja zaburza równowagę pożywki ze względu na gromadzenie się niepotrzebnych roślinom jonów.
Alkalizacja pożywki
Zbyt kwaśne roztwory alkalizuje się sodem kaustycznym (wodorotlenkiem sodu). Jak sama nazwa wskazuje, jest żrący, dlatego należy nosić gumowe rękawiczki. Zaleca się zakup wodorotlenku sodu w formie tabletek. W domowych sklepach chemicznych wodorotlenek sodu można kupić jako środek do czyszczenia rur, taki jak Mole. Jedną pastylkę rozpuścić w 0,5 l wody i stopniowo dodawać roztwór alkaliczny do pożywki, ciągle mieszając, często sprawdzając jej pH. Żadne obliczenia matematyczne nie są w stanie obliczyć, ile kwasu lub zasady należy dodać w danym przypadku.
Jeśli chcesz uprawiać kilka roślin na tej samej palecie, musisz je dobrać tak, aby pokrywały się nie tylko ich optymalne pH, ale także zapotrzebowanie na inne czynniki wzrostu. Na przykład żółte żonkile i chryzantemy potrzebują pH 6,8, ale różnych warunków wilgotności, więc nie mogą być uprawiane na tej samej palecie. Jeśli dasz żonkilom tyle wilgoci, co chryzantemy, cebulki żonkila zgniją. W doświadczeniach rabarbar osiągnął maksymalny rozwój przy pH 6,5, ale mógł rosnąć nawet przy pH 3,5. Owies, który preferuje pH około 6, daje dobre plony przy pH 4, jeśli dawka azotu w pożywce jest znacznie zwiększona. Ziemniaki rosną w dość szerokim zakresie pH, ale najlepiej rozwijają się przy pH 5,5. Poniżej tego pH uzyskuje się również wysokie plony bulw, ale nabierają one kwaśnego smaku. Aby uzyskać maksymalnie wysokiej jakości plony, pH pożywek musi być precyzyjnie ustawione.