Εκθέτης υδρογόνου (παράγοντας pH) Είναι ένα μέτρο της δραστηριότητας των ιόντων υδρογόνου σε ένα διάλυμα, που εκφράζει ποσοτικά την οξύτητά τους. Όταν το pH δεν είναι στα βέλτιστα επίπεδα, τα φυτά αρχίζουν να χάνουν την ικανότητά τους να απορροφούν ορισμένα από τα στοιχεία που είναι απαραίτητα για την υγιή ανάπτυξη. Όλα τα φυτά έχουν ένα συγκεκριμένο επίπεδο pH που επιτρέπει τα μέγιστα αποτελέσματα ανάπτυξης. Τα περισσότερα φυτά προτιμούν ένα ελαφρώς όξινο περιβάλλον ανάπτυξης (μεταξύ 5.5 και 6.5).
Εκθέτης υδρογόνου σε τύπους
Σε πολύ αραιά διαλύματα, το pH ισούται με τη συγκέντρωση των ιόντων υδρογόνου. Ίσο σε συντελεστή και αντίθετο πρόσημο με τον δεκαδικό λογάριθμο της δραστηριότητας των ιόντων υδρογόνου, εκφρασμένο σε mol ανά λίτρο:
pH = -lg [Η+]
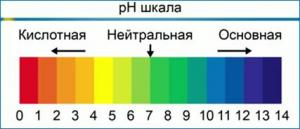
Υπό τυπικές συνθήκες, η τιμή του pH κυμαίνεται από 0 έως 14. Σε καθαρό νερό, σε ουδέτερο pH, η συγκέντρωση του Η+ ισούται με τη συγκέντρωση ΟΗ, και είναι 1-7 mole ανά λίτρο. Η μέγιστη δυνατή τιμή pH ορίζεται ως το άθροισμα του pH και του pOH και είναι ίση με 14.
Σε αντίθεση με τη δημοφιλή πεποίθηση, το pH μπορεί να κυμαίνεται όχι μόνο στην περιοχή από 0 έως 14, αλλά μπορεί επίσης να υπερβαίνει αυτά τα όρια. Για παράδειγμα, σε συγκέντρωση ιόντων υδρογόνου [Η+] = 10-15 mol/l, pH = 15, σε συγκέντρωση ιόντων υδροξειδίου [ΟΗ,] 10 mol/L pOH = -1.
Είναι σημαντικό να καταλάβουμε! Η κλίμακα του pH είναι λογαριθμική, που σημαίνει ότι κάθε μονάδα μεταβολής ισοδυναμεί με δεκαπλάσια αλλαγή στη συγκέντρωση των ιόντων υδρογόνου. Με άλλα λόγια, ένα διάλυμα pH 6 είναι δέκα φορές πιο όξινο από ένα διάλυμα pH 7, και ένα διάλυμα pH 5 θα είναι δέκα φορές πιο όξινο από ένα διάλυμα pH 6 και εκατό φορές πιο όξινο από ένα διάλυμα pH 7. Αυτό σημαίνει ότι όταν ρυθμίζετε το pH του θρεπτικού σας διαλύματος και πρέπει να αλλάξετε το pH σε δύο σημεία (για παράδειγμα, από 7.5 σε 5.5), θα πρέπει να χρησιμοποιείτε δέκα φορές περισσότερο διορθωτή pH από ό,τι αν αλλάζατε το pH σε ένα μόνο σημείο (από 7.5 έως 6.5).
Μέθοδοι για τον προσδιορισμό της τιμής του pH.
Διάφορες μέθοδοι χρησιμοποιούνται ευρέως για τον προσδιορισμό της τιμής του pH των διαλυμάτων. Το PH μπορεί να εκτιμηθεί χονδρικά με δείκτες, να μετρηθεί με ακρίβεια με ένα pHόμετρο ή να προσδιοριστεί αναλυτικά με ογκομέτρηση οξέος-βάσης.
Οξεοβασικοί δείκτες
Για μια χονδρική εκτίμηση της συγκέντρωσης των ιόντων υδρογόνου, χρησιμοποιούνται ευρέως δείκτες οξέος-βάσης – οργανικές χρωστικές ουσίες, το χρώμα των οποίων εξαρτάται από το pH του μέσου. Οι πιο διάσημοι δείκτες περιλαμβάνουν τη λακκούβα, τη φαινολοφθαλεΐνη, το μεθυλοπορτοκάλι (μεθυλοπορτοκάλι) και άλλους. Οι δείκτες μπορούν να υπάρχουν σε δύο διαφορετικές χρωματικές μορφές: όξινες ή βασικές. Η αλλαγή χρώματος κάθε δείκτη συμβαίνει στο εύρος οξύτητάς του, συνήθως 1-2 μονάδες.
καθολικός δείκτης

Διαλύματα τέτοιων μιγμάτων: οι «καθολικοί δείκτες» είναι συνήθως εμποτισμένοι με λωρίδες «χαρτιού ένδειξης», με τη βοήθεια των οποίων είναι δυνατός ο γρήγορος προσδιορισμός (με ακρίβεια μονάδων pH ή ακόμη και δέκατα του pH) η οξύτητα του διερευνημένα υδατικά διαλύματα. Για ακριβέστερο προσδιορισμό, το χρώμα του χαρτιού δείκτη που λαμβάνεται με την εφαρμογή μιας σταγόνας διαλύματος συγκρίνεται αμέσως με μια χρωματική κλίμακα αναφοράς, το σχήμα της οποίας φαίνεται στις εικόνες.
Ο προσδιορισμός του pH με τη μέθοδο του δείκτη είναι δύσκολος για θολά ή έγχρωμα διαλύματα.
Λαμβάνοντας υπόψη το γεγονός ότι οι βέλτιστες τιμές pH για τα θρεπτικά διαλύματα στην υδροπονία έχουν πολύ στενό εύρος (γενικά 5.5 έως 6.5), χρησιμοποιώ επίσης άλλους συνδυασμούς δεικτών. Για παράδειγμα, το υγρό μας τεστ pH έχει εύρος λειτουργίας και κλίμακα από 4.0 έως 8.0, γεγονός που το καθιστά πιο ακριβές από ένα γενικό χαρτί δείκτη.
μετρητής pH

Για μια πιο λεπτομερή μελέτη του θέματος, σας προτείνουμε να επισκεφτείτε την αντίστοιχη ενότητα του φόρουμ: “pHmeters”.
Ογκομετρική αναλυτική μέθοδος
Η αναλυτική ογκομετρική μέθοδος, οξεοβασική τιτλοδότηση, παρέχει επίσης ακριβή αποτελέσματα για τον προσδιορισμό της οξύτητας των διαλυμάτων. Ένα διάλυμα γνωστής συγκέντρωσης (τίτλος) προστίθεται στάγδην στο διάλυμα δοκιμής. Όταν αναμειγνύονται, συμβαίνει μια χημική αντίδραση. Το σημείο ισοδυναμίας, ο χρόνος κατά τον οποίο ο τιτλοδοτητής επαρκεί για την πλήρη ολοκλήρωση της αντίδρασης, ορίζεται από έναν δείκτη. Επιπλέον, γνωρίζοντας τη συγκέντρωση και τον όγκο του προστιθέμενου διαλύματος τιτλοδότησης, υπολογίζεται η οξύτητα του διαλύματος.
Επίδραση της θερμοκρασίας στις τιμές του pH

Ρυθμίστε το pH του θρεπτικού διαλύματος
Οξίνιση του θρεπτικού διαλύματος.
Γενικά, είναι απαραίτητο να οξινιστεί το θρεπτικό διάλυμα. Η απορρόφηση των ιόντων από τα φυτά προκαλεί σταδιακή αλκαλοποίηση του διαλύματος. Οποιοδήποτε διάλυμα έχει pH 7 ή περισσότερο θα πρέπει συχνά να ρυθμίζεται στο βέλτιστο pH. Μπορούν να χρησιμοποιηθούν διάφορα οξέα για την οξίνιση του θρεπτικού διαλύματος. Τα θειικά ή φωσφορικά οξέα είναι τα πιο χρησιμοποιούμενα. Μια καλύτερη λύση για υδροπονικά διαλύματα είναι τα ρυθμιστικά διαλύματα όπως pH μείον Bloom και pH μείον Grow. Αυτά τα κεφάλαια όχι μόνο φέρνουν τις τιμές του pH στο βέλτιστο, αλλά και σταθεροποιούν τις τιμές για παρατεταμένο χρονικό διάστημα.
Όταν ρυθμίζετε το pH με οξέα και αλκάλια, πρέπει να φοράτε λαστιχένια γάντια για να αποφύγετε εγκαύματα στο δέρμα. Ένας έμπειρος χημικός είναι έμπειρος στο χειρισμό του πυκνού θειικού οξέος, προσθέτοντας το οξύ σταγόνα-σταγόνα στο νερό. Αλλά για αρχάριους στην υδροπονία, ίσως είναι καλύτερο να απευθυνθείτε σε έναν έμπειρο χημικό και να του ζητήσετε να παρασκευάσει ένα διάλυμα θειικού οξέος 25%. Ενώ προστίθεται το οξύ, το διάλυμα αναδεύεται και προσδιορίζεται το ρΗ του. Έχοντας μάθει την κατά προσέγγιση ποσότητα θειικού οξέος, στο μέλλον μπορεί να προστεθεί από έναν βαθμονομημένο κύλινδρο.
Το θειικό οξύ πρέπει να προστίθεται σε μικρές μερίδες για να μην οξινίσει υπερβολικά το διάλυμα, το οποίο στη συνέχεια θα χρειαστεί να γίνει ξανά αλκαλικό. Σε έναν άπειρο εργάτη, η οξίνιση και η αλκαλοποίηση μπορούν να συνεχιστούν επ ‘αόριστον. Εκτός από τη σπατάλη χρόνου και αντιδραστηρίων, μια τέτοια ρύθμιση αποδυναμώνει την ισορροπία του θρεπτικού διαλύματος λόγω της συσσώρευσης περιττών ιόντων για τα φυτά.
Αλκαλοποίηση του θρεπτικού διαλύματος.
Τα υπερβολικά όξινα διαλύματα γίνονται αλκαλικά με καυστικό νάτριο (υδροξείδιο του νατρίου). Όπως υποδηλώνει το όνομα, είναι διαβρωτικό, επομένως πρέπει να φοράτε λαστιχένια γάντια. Συνιστάται η αγορά υδροξειδίου του νατρίου σε μορφή χαπιού. Το υδροξείδιο του νατρίου μπορεί να αγοραστεί ως καθαριστικό σωλήνων σε καταστήματα οικιακών χημικών, όπως το Mole. Διαλύουμε ένα κόκκο σε 0,5 L νερό και προσθέτουμε σταδιακά το αλκαλικό διάλυμα στο θρεπτικό διάλυμα με συνεχή ανάδευση, ελέγχοντας συχνά το pH του. Κανένας μαθηματικός υπολογισμός δεν μπορεί να υπολογίσει την ποσότητα οξέος ή αλκαλίου που θα προστεθεί σε μια δεδομένη περίπτωση.
Εάν θέλετε να καλλιεργήσετε πολλές καλλιέργειες σε ένα μυστρί, πρέπει να τις επιλέξετε ώστε να ταιριάζουν όχι μόνο με το βέλτιστο pH τους, αλλά και με τις ανάγκες άλλων αυξητικών παραγόντων. Για παράδειγμα, οι νάρκισσοι και τα κίτρινα χρυσάνθεμα χρειάζονται pH 6,8, αλλά διαφορετικές συνθήκες υγρασίας, επομένως δεν μπορούν να καλλιεργηθούν στην ίδια παλέτα. Αν δώσετε στους νάρκισσους τόση υγρασία όσο στα χρυσάνθεμα, οι βολβοί του νάρκισσου θα σαπίσουν. Σε πειράματα, το ραβέντι έφτασε στη μέγιστη ανάπτυξή του σε pH 6,5, αλλά ήταν σε θέση να αναπτυχθεί ακόμη και σε pH 3,5. Η βρώμη, που προτιμά pH περίπου 6, δίνει καλές αποδόσεις σε pH 4, εάν η δόση του αζώτου στο θρεπτικό διάλυμα αυξηθεί σημαντικά. Οι πατάτες αναπτύσσονται σε αρκετά μεγάλο εύρος pH, αλλά ευδοκιμούν καλύτερα σε pH 5,5. Κάτω από αυτό το pH, λαμβάνονται επίσης υψηλές αποδόσεις κονδύλων, οι οποίοι όμως αποκτούν πικρή γεύση. Για να επιτευχθούν μέγιστες αποδόσεις υψηλής ποιότητας, το pH των θρεπτικών διαλυμάτων πρέπει να ρυθμίζεται με ακρίβεια.